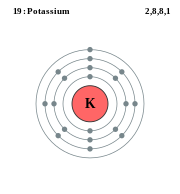
3:51 PM კალიუმი | |
ფიზიკური თვისებებიმოვერცხლისფრო-თეთრი მეტალია. სიმკვრივე 0,86 გ/სმ3, ძალიან მსუბუქია, ადვილად იჭრება დანით. ბუნებრივი კალიუმი შედგება ორი სტაბილური 3919K (93,08%) და 4119K (6,91%) და ერთი რადიოაქტიური იზოტოპისაგან 4019K (0,01%). ლღობის ტემპერატურა 100 0C-ზე დაბალია. იზოტოპები
ბუნებაში ტუტე მეტალები თავისუფალი სახით არ გვხვდებიან. კალიუმი შედის სხვადასხვა მინერალების და მთის ქანების-სილიკატების შედგენილობაში. მიწის ზედაპირის მყარ ქერქში ის ასზე მეტ მინერალს წარმოშობს, გარდა ამისა, მცირე რაოდენობით ის ასეულობით სხვა მინერალების შემადგენლობაშიც შედის. მისი საშუალო შემადგენლობა მიწის ქერქში 2,5% უახლოვდება. ეს საკმაოდ დიდი რიცხვია და იმის მაჩვენებელია, რომ კალიუმი გაბატონებულ ელემენტთა რიცხვს ეკუთვნის. მიწაზე კალიუმის ატომების აკვანს გრანიტები და მჟავე ლავები წარმოადგენენ. ეს ქანები ადვილად იშლებიან მიწის ზედაპირზე-ჰაერის,წყლისა და ნახშირმჟავას მოქმედებით. როდესაც დედამიწის სიღრმეში ცივდება გამდნარი მაგმა და ცალკეული ელემენტები მასში მოძრაობის უნარის, მქროლადი გაზების ანდა, პირიქით, მოძრავ, ადვილად მდნადი ნაწილაკების წარმოქმნის მიდრეკილების მიხედვით ნაწილდებიან, კალიუმი სწორედ ამ უკანასკნელთ მიეკუთვნება. კალიუმი შავი და თეთრი ფერის ქარსების შემადგენლობაშიც შედის.ოკეანეთა ფსკერის ბაზალტურ ქანებში კი ის 0,3%-ზე მეტი არ არის. ზღვის წყალში მის მხოლოდ უმნიშვნელო რაოდენობას ვხვდებით, დედა-ქანებში კალიუმის ყოველი 1000 ატომიდან ზღვის აუზს მხოლოდ 2 ატომი აღწევს, 998-ს კი ნიადაგის საფარი შთანთქავს და ამაშია ნიადაგის სასწაულებრივი ძალა. კალიუმის ატომები იმდენად თავისუფლად არიან შებმული ნიადაგთან, რომ მცენარის ყოველ უჯრედს თავისუფლად შეუძლია მათი შთანთქმა და თავის სასიცოცხლოდ გამოყენება. ამგვარად, თავისი მიგრაციის ერთ-ერთ ციკლს კალიუმი ნიადაგიდან იწყებს: ის შეიწოვება მცენარეთა ფესვებით, გროვდება მათ მკვდარ დანაგროვებში, ნაწილობრივ გადადის ცხოველისა და ადამიანის ორგანიზმებში და ისევ ლპობის შედეგად უბრუნდება ნიადაგს, საიდანაც ის ოდესღაც ცოცხალმა უჯრედმა ამოიტანა. ქიმიური თვისებები
კალიუმის ოქსიდი კი მიიღება ჟანგბადით ღარიბ გარემოში ლითონის გახურებით, არა უმეტეს 180 °C ან კალიუმის სუპეროქსიდის გახურებით კალიუმ ლითონთან ერთად
| |
|
| |
| სულ კომენტარები: 0 | |

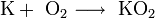

 (კალიუმის ჰიპეროქსიდი).
(კალიუმის ჰიპეროქსიდი).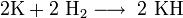 ,
, ,
, კალიუმი იწვის იისფერი ალით, მისი წვის შედეგად მიიღება ზეჟანგები ფხვნილის სახით
კალიუმი იწვის იისფერი ალით, მისი წვის შედეგად მიიღება ზეჟანგები ფხვნილის სახით